
A. La cristallogénèse
Un cristal est composé d'un motif de base qui, répété périodiquement dans les trois dimensions de l’espace, forme le solide.
On distingue deux types de solides : les solides ioniques et les solides moléculaires.
Formation des cristaux ioniques :
Un sel est un assemblage d'anions et de cations (par exemple le sel de cuisine, NaCl, est constitué d'un ion sodium Na+ (cation), et d'un ion chlorure Cl-(anion). Les ions de charges opposées s’attirent et forment des liaisons ioniques. Un cristal ionique est constitué uniquement de sels. Il est électriquement neutre.
Si on dissout un cristal ionique dans l’eau, ses liaisons se brisent et ses ions se dispersent. Lorsque l’eau s’évapore, les ions s’attirent de nouveau et le cristal ionique se reforme.
C’est par exemple par évaporation que l’on obtient du sel de cuisine (NaCl).
Dans le cristal de NaCl, les ions s'assemblent selon un schéma cubique. Le cristal est électriquement neutre (il comporte autant d’ions Na+ que d’ions Cl-, et chacun d'eux possède une charge).
2. Les étapes de la formation en laboratoire
Pour former des cristaux, il existe 2 étapes majeures.
Tout d’abord, la nucléation. Dans le milieu liquide (ici une solution aqueuse), les molécules s'agitent et s'assemblent sous l'action de différentes intéractions : intéractions de Van de Waals (dipôle-dipôle) et liaisons hydrogène. Cela permet la formation d’un nucléon. Pour favoriser la rencontre entre les molécules, on sature la solution pour avoir plus de chance d’obtenir des nucléations.
Ensuite, la croissance. Lors de cette étape les molécules s’alignent et les germes poussent. Si la croissance se fait trop rapidement, des défauts cristallins apparaissent et cela peut arrêter la croissance. Il y a donc une mauvaise cristallisation qui peut donner un précipité.
Afin d’obtenir des cristaux purs, il est préférable d’avoir une solution peu saturée au risque de ne pas obtenir de nucléation car une solution trop saturée est propice à une malformation lors de la croissance.
Ce juste équilibre ne peut être obtenu qu’en optimisant les conditions de cristallisation.
Pour créer un cristal pur, il ne faut pas que sa pousse dépasse un certain temps, de sorte qu’il ne comporte pas trop de défauts. Néanmoins, il est nécessaire d’attendre que la croissance du cristal soit suffisamment développée.
1. Rôle des liaisons ioniques et moléculaires dans la formation d'un cristal
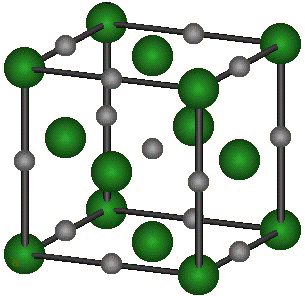
Les ions Na+ sont représentés en gris et les ions Cl- en vert.
http://www.lerepairedessciences.fr/reflexions/questions_cours_fichiers/dissolution_cristal.htm
Formation des cristaux moléculaires :
Une molécule est formée d'atomes qui s'assemblent par des liaisons covalentes: chaque atome met en commun un électron de sa couche externe, ou plus pour des liaisons doubles ou triples. Les cristaux moléculaires s'assemblent essentiellement par des liaisons de Van der Waals (interactions entre dipôles) et quelques liaisons hydrogène.
Par exemple le saccharose C12H22O11 est un cristal moléculaire.

